En la actualidad, los sistemas de salud se enfrentan a retos sin precedentes, como son el envejecimiento poblacional, la creciente prevalencia de enfermedades crónicas y la presión económica que tensiona los recursos disponibles. Ante este escenario, resulta imprescindible impulsar una profunda transformación que vaya más allá de la mera optimización de procesos tradicionales. Dos palancas digitales emergen con fuerza como pilares de esta renovación. Por un lado, la medicina de precisión, que gracias al análisis genómico, la estratificación de riesgos y el uso de biomarcadores permite adaptar tratamientos a las características únicas de cada paciente; y, por otro, la inteligencia artificial, cuya capacidad de procesar grandes volúmenes de datos, aprender de patrones y generar algoritmos predictivos abre nuevas vías para la detección temprana, la toma de decisiones clínicas y la gestión proactiva de la salud poblacional. Ambas palancas, profundamente digitales, no solo prometen mejorar la eficiencia y la calidad asistencial, sino también redefinir el modelo de atención, pasando de una medicina reactiva a otra verdaderamente preventiva y centrada en el individuo. Este artículo explora cómo la convergencia entre medicina de precisión e inteligencia artificial puede sentar las bases de un sistema de salud más inteligente, accesible y sostenible.
La IA se despliega en diferentes ámbitos. Por ejemplo, en el sanitario, donde en un entorno hospitalario cada vez más saturado de información (desde registros electrónicos de salud hasta flujos incesantes de datos de dispositivos biométricos y resultados de pruebas), se corre el riesgo de reducir la práctica clínica a una tarea mecánica. Es decir, situar al médico como mero “operador de datos” (concepto que hace referencia Eric Topol en libro Deep Medicine). Sin embargo, la verdadera revolución impulsada por la inteligencia artificial trasciende la capacidad analítica de los algoritmos. Al integrar sistemas que no solo procesan información, sino que comprenden patrones y matices contextuales, la IA provoca un cambio de paradigma cultural. Ya no se trata de emitir alertas o de señalar anomalías, sino de transformar la labor clínica en una experiencia colaborativa y centrada en el paciente.
En este nuevo escenario, el profesional sanitario deja de ser un receptor pasivo de notificaciones para erigirse en un “intérprete de contextos”. Es decir, su función principal pasa a ser analizar los datos enriquecidos por la IA (tendencias de salud poblacional, predicciones de riesgo personalizado, preferencias y circunstancias de vida del paciente) y traducirlos en decisiones compartidas y en intervenciones adaptadas a la realidad de cada individuo. De esta manera, la tecnología deja de ser un mero instrumento de apoyo para convertirse en el catalizador de una cultura hospitalaria orientada a la empatía, la prevención y la experiencia integral del paciente. El clínico, lejos de perder protagonismo, ve reforzado su rol como guía y facilitador, capaz de diseñar trayectorias asistenciales únicas que integren conocimiento científico, contexto personal y un enfoque verdaderamente humano.
Transformación del profesional y el centro
Estos hospitales se ven transformados en todos los servicios, pero, entre los mas representativos, se encuentran los servicios de diagnostico por imagen, donde la IA está avanzando de una manera muy clara, siendo una herramienta clave para el día a día de los radiólogos. Igualmente, otro de los servicios donde esta entrando la IA con fuerza es el de las unidades de cuidados intensivos (UCI), donde cada minuto puede marcar la diferencia entre la vida y la muerte. El registro electrónico de salud (EHR) ha dejado de entenderse como un simple archivo estático de datos clínicos y, lejos de ser un “repositorio pasivo”, el EHR se convierte en un auténtico “flujo de señales” que, al ser alimentado por modelos de inteligencia artificial entrenados sobre grandes volúmenes de información, es capaz de detectar patrones sutiles y anticipar descompensaciones hasta 12–24 horas antes de que el paciente reúna los criterios convencionales de alarma.
Tradicionalmente, el equipo de enfermería y los médicos en la UCI respondían de forma reactiva, ya que observaban signos vitales anómalos (como hipotensión o taquipnea) y actuaban en el momento en que estos alcanzaban umbrales críticos. Con la introducción de la IA, se adopta un enfoque de “vigilancia predictiva” permanente, donde las alertas no esperan a que los parámetros se desborden. Así, el equipo clínico puede intervenir de manera preventiva ajustando la administración de fluidos, modificando dosis de fármacos o solicitando pruebas de imagen antes de que el paciente requiera un ingreso urgente en la UCI. Esta transformación cultural y operativa, impulsada por el EHR como flujo continuo de datos enriquecido por algoritmos predictivos, redefine la práctica en cuidados intensivos y abre la puerta a una medicina verdaderamente proactiva y personalizada.
Estos EHR ya no se convierten en soluciones para registrar la información y hacer el foco en que esta esta perfectamente estructurada, sino en sistemas que, a través la ingesta de información multi modalidad (voz que transmite el profesional, datos obtenidos de los dispositivos médicos, señales, imagen, etc.), van guiando y ayudando al profesional a tomar decisiones de manera proactiva. Y aquí es donde aparecen nuevos profesionales, perfiles y actores en el sistema de salud que ha de transformarse no únicamente digitalmente sino en sus estructuras y organizaciones, creando nuevos perfiles como los data scientist o los profesionales de salud digital.
Aplicaciones prácticas
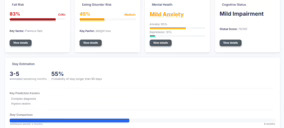
Un claro ejemplo seria un caso de uso donde en el núcleo de esta estrategia innovadora se encuentra un equipo interdisciplinario formado por data scientists, enfermeros y médicos de urgencias que analiza de manera continua y colaborativa los registros electrónicos de salud. Cada mañana, este grupo revisa el rendimiento de los modelos de machine learning aplicados al flujo de datos clínicos de pacientes hospitalizados. Cuando el algoritmo detecta una probabilidad superior al 30% de desarrollar sepsis en las siguientes 12 horas, se genera automáticamente una alerta dirigida a la enfermera de turno.
Esta alerta no es genérica, ya que incluye los tres indicadores clave que más han reforzado la predicción, por ejemplo, elevaciones súbitas de la procalcitonina, alteraciones en el recuento de glóbulos blancos o variabilidad en la presión arterial; y va acompañada de un protocolo de actuación estandarizado. En los siguientes 60 minutos, la enfermera debe medir el nivel de lactato en sangre, obtener hemocultivos y administrar fluidos de forma pautada.
Al centrar el esfuerzo no en el diagnóstico tardío (“descubrir la sepsis” cuando ya se han cumplido los criterios clínicos convencionales), sino en su prevención precoz, este enfoque ha conseguido reducir la mortalidad por sepsis en un 15 % en tan solo seis meses. El resultado es un modelo asistencial donde la tecnología y la experiencia clínica convergen para anticiparse a la gravedad, mejorando la seguridad del paciente y optimizando el uso de recursos en el entorno hospitalario.
Si las organizaciones de salud tienen la oportunidad de transformarse con el despliegue de la IA, tienen la obligación de transformarse con el despliegue de la medicina de precisión.
En un momento en que los avances científicos y tecnológicos redefinen los límites de la práctica clínica, la medicina de precisión se alza como una de las palancas más prometedoras para mejorar resultados de salud y optimizar recursos. Basada en el análisis detallado de la información genética, molecular, ambiental y de estilo de vida de cada paciente, esta aproximación abandona el paradigma de “tratamiento para la población” para diseñar intervenciones realmente individualizadas. Sin embargo, su implementación exitosa exige mucho más que la disponibilidad de pruebas genómicas o algoritmos avanzados: requiere una transformación profunda de las organizaciones de salud. Comenzando con la disponibilidad de infraestructuras digitales, capaces de integrar y analizar volúmenes masivos de datos heterogéneos, así como la gestión de un nuevo ciclo de vida del dato que es diferente al hasta ahora trabajado.
En segundo lugar, las organizaciones deben evolucionar hacia estructuras colaborativas y multidisciplinares, donde biólogos, genetistas, data scientists, farmacólogos y clínicos trabajen de la mano. La formación continua del personal sanitario en nuevas tecnologías, la creación de “comités de revisión de variantes genómicas” y la incorporación de roles especializados (como consejeros genéticos) son pasos clave para integrar el conocimiento molecular en la toma de decisiones diarias.
Esta transformación se ha de realizar de la mano del ámbito de la investigación, donde el procesamiento de la información genómica en España se tiene una amplia experiencia y conocimiento.
Avance de la Medicina de Precisión
Un claro ejemplo es el proyecto IMPACT (Infraestructura de Medicina de Precisión asociada a la Ciencia y la Tecnología), una iniciativa liderada por el Instituto de Salud Carlos III, lanzada en 2024, cuyo objetivo es crear una plataforma nacional que integre datos clínicos, genómicos, ambientales y socioeconómicos para avanzar en MdP con IA como soporte central. Entre sus objetivos específicos destacan la centralización y homologación de datos, con intención de homogeneizar formatos procedentes de los 17 biobancos regionales para facilitar análisis transversales; la creación de Pipelines de IA, con el desarrollo de flujos de trabajo automatizados que, desde la entrada de datos brutos (secuenciación de exomas/genomas), extraigan biomarcadores de mutaciones relevantes en oncología, cardiología y enfermedades raras; y proyectos de validación clínica, a través de ensayos piloto en 10 hospitales del SNS para testar algoritmos de predicción de respuesta a quimioterapia en cáncer de mama y de riesgo cardiovascular en pacientes con patologías metabólicas.
En marzo de 2025, el ISCIII publicó un informe en el que se destaca que, durante el primer año de operación de IMPACT, se han integrado datos de más de 5.000 pacientes oncológicos, generando modelos predictivos con una precisión superior al 85 % en la estratificación de respuesta a terapias dirigidas específicas, frente al 60 % de las guías clínicas convencionales. Además, se ha habilitado un nodo central en la nube del Centro Nacional de Supercomputación (BSC-CNS) que procesa 200 TB de datos mensuales, permitiendo entrenar redes neuronales profundas que identifican firmas genéticas asociadas a la progresión tumoral.
Bajo esta visión del proyecto IMPACT donde de manera colaborativa y en forma de red diferentes centreos trabajan de manera coordinada se ha lanzado el proyecto SIGenES en el ámbito del SNS y como herramienta para el despliegue de la cartera de genética del SNS.
El proyecto SIGenES (Sistema de Información para la Integración de la Información Genómica en el SNS) tiene por objeto disponer de una red para compartir datos genómicos en todo el territorio español. Financiado por el Plan de Recuperación, Transformación y Resiliencia de la Unión Europea (NextGeneration EU), este proyecto permitirá disponer de una biblioteca de variantes genómicas, con la centralización de un repositorio de variantes genéticas anotadas y validadas, accesible para todos los centros del SNS, que sirva de apoyo al diagnóstico y al diseño de pruebas genéticas en el marco de la cartera común de servicios de medicina de precisión.