Aplicaciones prácticas
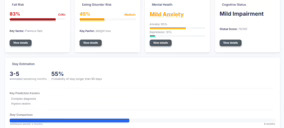
Un claro ejemplo seria un caso de uso donde en el núcleo de esta estrategia innovadora se encuentra un equipo interdisciplinario formado por data scientists, enfermeros y médicos de urgencias que analiza de manera continua y colaborativa los registros electrónicos de salud. Cada mañana, este grupo revisa el rendimiento de los modelos de machine learning aplicados al flujo de datos clínicos de pacientes hospitalizados. Cuando el algoritmo detecta una probabilidad superior al 30% de desarrollar sepsis en las siguientes 12 horas, se genera automáticamente una alerta dirigida a la enfermera de turno.
Esta alerta no es genérica, ya que incluye los tres indicadores clave que más han reforzado la predicción, por ejemplo, elevaciones súbitas de la procalcitonina, alteraciones en el recuento de glóbulos blancos o variabilidad en la presión arterial; y va acompañada de un protocolo de actuación estandarizado. En los siguientes 60 minutos, la enfermera debe medir el nivel de lactato en sangre, obtener hemocultivos y administrar fluidos de forma pautada.
Al centrar el esfuerzo no en el diagnóstico tardío (“descubrir la sepsis” cuando ya se han cumplido los criterios clínicos convencionales), sino en su prevención precoz, este enfoque ha conseguido reducir la mortalidad por sepsis en un 15 % en tan solo seis meses. El resultado es un modelo asistencial donde la tecnología y la experiencia clínica convergen para anticiparse a la gravedad, mejorando la seguridad del paciente y optimizando el uso de recursos en el entorno hospitalario.
Si las organizaciones de salud tienen la oportunidad de transformarse con el despliegue de la IA, tienen la obligación de transformarse con el despliegue de la medicina de precisión.
En un momento en que los avances científicos y tecnológicos redefinen los límites de la práctica clínica, la medicina de precisión se alza como una de las palancas más prometedoras para mejorar resultados de salud y optimizar recursos. Basada en el análisis detallado de la información genética, molecular, ambiental y de estilo de vida de cada paciente, esta aproximación abandona el paradigma de “tratamiento para la población” para diseñar intervenciones realmente individualizadas. Sin embargo, su implementación exitosa exige mucho más que la disponibilidad de pruebas genómicas o algoritmos avanzados: requiere una transformación profunda de las organizaciones de salud. Comenzando con la disponibilidad de infraestructuras digitales, capaces de integrar y analizar volúmenes masivos de datos heterogéneos, así como la gestión de un nuevo ciclo de vida del dato que es diferente al hasta ahora trabajado.
En segundo lugar, las organizaciones deben evolucionar hacia estructuras colaborativas y multidisciplinares, donde biólogos, genetistas, data scientists, farmacólogos y clínicos trabajen de la mano. La formación continua del personal sanitario en nuevas tecnologías, la creación de “comités de revisión de variantes genómicas” y la incorporación de roles especializados (como consejeros genéticos) son pasos clave para integrar el conocimiento molecular en la toma de decisiones diarias.
Esta transformación se ha de realizar de la mano del ámbito de la investigación, donde el procesamiento de la información genómica en España se tiene una amplia experiencia y conocimiento.